氫氧燃料電池的電極反應(yīng)式和總反應(yīng)式?
作者:訪客發(fā)布時間:2021-07-20分類:催化劑及助劑瀏覽:139
氫氧燃料電池(中性介質(zhì))
正極:O2 + 2H2O + 4e- → 4OH-
負(fù)極:2H2 - 4e- → 4H+
總反應(yīng)式:2H2 + O2 == 2H2O
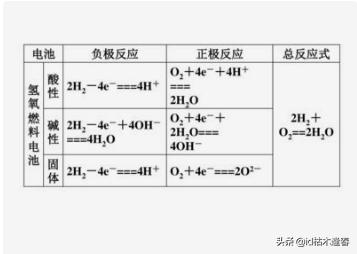
氫氧燃料電池(酸性介質(zhì))
正極:O2 + 4H+ + 4e- → 2H2O
負(fù)極:2H2 - 4e-→ 4H+
總反應(yīng)式:2H2 + O2 == 2H2O
氫氧燃料電池(堿性介質(zhì))
正極:O2 + 2H2O + 4e- → 4OH-
負(fù)極:2H2 - 4e- + 4OH- → 4H2O
總反應(yīng)式:2H2 + O2 == 2H2O
氫氧燃料電池的電極方程式,酸性條件下?
因為燃料電池正極反應(yīng)物一律是氧氣,正極都是氧化劑氧氣得到電子的還原反應(yīng),所以可先寫出正極反應(yīng)式,正極反應(yīng)的本質(zhì)都是O2得電子生成O2-離子,故正極反應(yīng)式的基礎(chǔ)都是O2+4e-=2O2-。正極產(chǎn)生O2-離子的存在形式與燃料電池的電解質(zhì)的狀態(tài)和電解質(zhì)溶液的酸堿性有著密切的關(guān)系。電解質(zhì)為酸性電解質(zhì)溶液(如稀硫酸)在酸性環(huán)境中,O2-離子不能單獨存在,可供O2-離子結(jié)合的微粒有H+離子和H2O,O2-離子優(yōu)先結(jié)合H+離子生成H2O。這樣在酸性電解質(zhì)溶液中,正極反應(yīng)式為O2+4H++4e-=2H2O。電解質(zhì)為中性或堿性電解質(zhì)溶液(如氯化鈉溶液或氫氧化鈉溶液),在中性或堿性環(huán)境中O2-離子也不能單獨存在,O2-離子只能結(jié)合H2O生成OH-離子,故在中性或堿性電解質(zhì)溶液中,正極反應(yīng)式為O2+2H2O +4e-=4OH-。擴(kuò)展資料:注意事項:
1、電池的負(fù)極一定是可燃性氣體,失電子,元素化合價升高,發(fā)生氧化還原反應(yīng);電池的正極一定是助燃性氣體,得電子,化合價降低,發(fā)生還原反應(yīng)。
2、燃料電池兩電極材料一般都不參加反應(yīng),反應(yīng)的是通到電極上的燃料和氧氣,兩電極只是傳導(dǎo)電子的作用。
3、電極反應(yīng)式作為一種特殊的離子反應(yīng)方程式,也必需遵循原子守恒,得失電子守恒,電荷守恒。
4、寫電極反應(yīng)時一定要注意電解質(zhì)是什么,其中的離子要和電極反應(yīng)中出現(xiàn)的離子相對應(yīng),在堿性電解質(zhì)中,電極反應(yīng)式不能出現(xiàn)氫離子,在酸性電解質(zhì)溶液中,電極反應(yīng)式不能出現(xiàn)氫氧根離子。
5、正負(fù)兩極的電極反應(yīng)式在得失電子守恒的條件下,相疊加后的電池反應(yīng)必須是燃料燃燒反應(yīng)和燃料產(chǎn)物于電解質(zhì)溶液反應(yīng)的疊加反應(yīng)式。
- 催化劑及助劑排行
- 最近發(fā)表


