高中化學,氫氧燃料電池為什么氫氣會自發失去電子?
作者:訪客發布時間:2021-07-20分類:催化劑及助劑瀏覽:221
導讀:它不是無緣無故的失電子,氫氧燃料電池是水的電解的逆反應,它的內部構造很復雜的,不想你想的那么簡單, 氫氧燃料電池工作時,向氫電極供應氫氣,同時向氧電極供應氧氣。氫、氧氣在電極上的催...
它不是無緣無故的失電子,氫氧燃料電池是水的電解的逆反應,它的內部構造很復雜的,不想你想的那么簡單, 氫氧燃料電池工作時,向氫電極供應氫氣,同時向氧電極供應氧氣。氫、氧氣在電極上的催化劑作用下,通過電解質生成水,這時在氫電極上有多余的電子而帶負電,在氧電極上由于缺少電子而帶正電。接通電路后,這一類似于燃燒的反應過程就能連續進行。
氫氧燃料電池的電極反應式和總反應式?
氫氧燃料電池(中性介質)
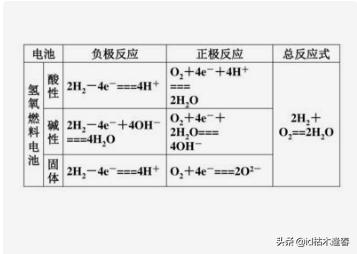
正極:O2 + 2H2O + 4e- → 4OH-
負極:2H2 - 4e- → 4H+
總反應式:2H2 + O2 == 2H2O
氫氧燃料電池(酸性介質)
正極:O2 + 4H+ + 4e- → 2H2O
負極:2H2 - 4e-→ 4H+
總反應式:2H2 + O2 == 2H2O
氫氧燃料電池(堿性介質)
正極:O2 + 2H2O + 4e- → 4OH-
負極:2H2 - 4e- + 4OH- → 4H2O
總反應式:2H2 + O2 == 2H2O
- 催化劑及助劑排行
- 最近發表


